കോപ്പർ(I) ക്ലോറൈഡ്


കുപ്രസ് ക്ലോറൈഡെന്നും അറിയപ്പെടുന്ന രാസസംയുക്തമാണ് കോപ്പർ(I) ക്ലോറൈഡ് (CuCl). +1 ഓക്സീകരണ അവസ്ഥയിൽ കോപ്പർ അടങ്ങിയിട്ടുള്ള ഈ രാസസംയുക്തത്തിൽ ക്ലോറൈഡ് അയോണുകളുണുകളുമുണ്ട്. വെള്ള നിറത്തിൽ ഖരാവസ്ഥയിൽ കാണപ്പെടുന്ന കോപ്പർ(I) ക്ലോറൈഡ് കോൺസൻറേറ്റഡ് ഹൈഡ്രോക്ലോറിക് അമ്ലത്തിൽ പൂർണ്ണമായും ജലത്തിൽ ഭാഗികമായും ലയിക്കുന്നു. ശുദ്ധമായ കോപ്പർ(I) ക്ലോറൈഡ് വെള്ള നിറത്തിലും ശുദ്ധമല്ലാത്ത കോപ്പർ(I) ക്ലോറൈഡിൽ കോപ്പർ(II) ക്ലോറൈഡിന്റെ സാന്നിധ്യമുള്ളതു കൊണ്ട് അവ പച്ചനിറത്തിലും കാണപ്പെടുന്നു.[1]
ചരിത്രം
പതിനേഴാം നൂറ്റാണ്ടിൽ ജീവിച്ചിരുന്ന ഭൗതിക ശാസ്ത്രജ്ഞനായിരുന്ന റോബർട്ട് ബോയിലാണ്[2] ആദ്യമായി മെർക്കുറി(II) ക്ലോറൈഡ്, കോപ്പർ എന്നിവയിൽ നിന്നും കോപ്പർ(I) ക്ലോറൈഡ് തയ്യാറാക്കിയത്.
- HgCl2 + 2 Cu → 2 CuCl + Hg
1799 ൽ ജോസഫ് പ്രൗസ്റ്റ് കോപ്പറിലെ രണ്ടു വ്യത്യസ്ത ക്ലോറൈഡുകളെ സ്വഭാവ സവിശേഷതകളുസരിച്ച് വിവരിച്ചു. അദ്ദേഹം വായുവിന്റെ അഭാവത്തിൽ CuCl2 ചൂടാക്കി കോപ്പർ(I) ക്ലോറൈഡ് ഉണ്ടാക്കി. ഇതുകാരണം അതിന്റെ സംയോജിത ക്ലോറിൻ പകുതി നഷ്ടപ്പെടുകയും, തുടർന്ന് അവശേഷിച്ച കോപ്പർ(II) ക്ലോറൈഡ് ജലമുപയോഗിച്ച് നീക്കം ചെയ്തു.[3]
ആദ്യകാലങ്ങളിൽ വാതകത്തിലെ കാർബൺ മോണോക്സൈഡിന്റെ അളവ് കണ്ടുപിടിക്കുന്നതിനുവേണ്ടിയാണ് അമ്ല സ്വഭാവമുള്ള കോപ്പർ(I) ക്ലോറൈഡ് ലായനി ഉപയോഗിച്ചിരുന്നത്. ഹെംപൽസ് ഗ്യാസ് അപ്പാരറ്റസ് ഇതിനൊരുദാഹരണമാണ്.[4]
വ്യാവസായിക നിർമ്മാണം
വ്യാവസായികമായി കോപ്പർ(I) ക്ലോറൈഡ് 450-900 ഡിഗ്രി സെൽഷ്യസിൽ കോപ്പർ ലോഹവും ക്ലോറിനും ഉപയോഗിച്ച് നിർമ്മിക്കുന്നു:[5][6]
- 2 Cu + Cl2 → 2 CuCl
ഇതുകൂടാതെ സൾഫർ ഡയോക്സൈഡ് അല്ലെങ്കിൽ അസ്കോർബിക് ആസിഡ് (വിറ്റാമിൻ സി) തുടങ്ങിയ റെഡ്യൂസിങ് ഏജന്റുകൾ ഉപയോഗിച്ച് കോപ്പർ(II) ക്ലോറൈഡ് കുറയ്ക്കുന്നതിലൂടെ കോപ്പർ (I) ക്ലോറൈഡ് തയ്യാറാക്കാനാകും.[7]
- 2 CuCl2 + SO2 + 2 H2O → 2 CuCl + H2SO4 + 2 HCl
സ്വഭാവസവിശേഷതകൾ
ആംബിയന്റ് അവസ്ഥയിൽ കോപ്പർ (I) ക്ലോറൈഡിന് ക്യൂബിക് സിങ്ക് ബ്ലെൻഡ് ക്രിസ്റ്റൽ ഘടനയാണുള്ളത്. എന്നാൽ 408 ഡിഗ്രി സെൽഷ്യസിലേക്ക് ചൂടാക്കുമ്പോൾ ഘടന ഷഡ്ഭുജാകൃതിയിലേയ്ക്കു മാറുന്നു.
കോപ്പർ (I) ക്ലോറൈഡ് ഒരു ലൂയിസ് ആസിഡാണ്. ഹാർഡ്-സോഫ്റ്റ് ആസിഡ്-ബേസ് സങ്കല്പ്മനുസരിച്ച് അനുസരിച്ച് കോപ്പർ (I) ക്ലോറൈഡിനെ മൃദുവായി വർഗീകരിച്ചിരിക്കുന്നു. അങ്ങനെ, ട്രൈഫിനൈൽഫോസ്ഫൈൻ പോലുള്ള സോഫ്റ്റ് ലൂയിസ് ബേസുകളുടെ കൂടെ ചേർന്ന് സ്ഥിരതയുള്ള കോമ്പ്ലക്സുകൾ രൂപപ്പെടുത്താൻ കോപ്പർ (I) ക്ലോറൈഡ് ശ്രമിക്കുന്നു.
- CuCl + P(C6H5)3 → [CuCl(P(C6H5)3)]4
കോപ്പർ (I) ക്ലോറൈഡ് ജലത്തിൽ ലയിക്കുന്നില്ലെങ്കിലും അനുയോജ്യമായ ഡോണർ തന്മാത്രകൾ അടങ്ങിയിരിക്കുന്ന അക്വസ് ലായനിയിൽ ഇത് ലയിക്കുന്നു.
കോപ്പർ (I) ക്ലോറൈഡ് ഹൈഡ്രോക്ലോറിക് അമ്ലവുമായോ അല്ലെങ്കിൽ അമോണിയയുമായോ ചേർന്നുണ്ടാകുന്ന ലായനി കാർബൺ മോണോക്സൈഡിനെ ആഗിരണം ചെയ്ത് ക്ലോറൈഡ്-ബ്രിഡ്ജ്ഡ് ഡൈമർ [CuCl(CO)]2 പോലുള്ള നിറമില്ലാത്ത കോംപ്ലക്സുകളെ ഉണ്ടാക്കുന്നു. ഇതേ ഹൈഡ്രോക്ലോറിക് അമ്ലലായനി അസറ്റിലീൻ വാതകവുമായി രാസപ്രക്രിയയിലേർപ്പെട്ട് [CuCl(C2H2)] ഉണ്ടാകുന്നു. കോപ്പർ (I) ക്ലോറൈഡിന്റെ അമോണിയാക്കൽ ലായനി അസറ്റിലീനുമായി രാസപ്രക്രിയയിലേർപ്പെട്ട് സ്ഫോടകവസ്തുവായ കോപ്പർ (I) അസറ്റലീഡ്, Cu2C2 ഉണ്ടാകുന്നു.
ഉപയോഗങ്ങൾ
കുമിൾനാശിനി കോപ്പർ ഓക്സിക്ലോറൈഡിന്റെ പ്രികർസറായി കോപ്പർ(I) ക്ലോറൈഡ് ഉപയോഗിക്കുന്നു. ഇതിനുവേണ്ടി കോംപ്രൊപോർഷനേഷൻ വഴി അക്വസ് കോപ്പർ(I) ക്ലോറൈഡ് ഉണ്ടാക്കിയതിനു ശേഷം എയർ-ഓക്സിഡൈസ് ചെയ്യുന്നു.
- Cu + CuCl2 → 2 CuCl
- 4 CuCl + O2 + 2 H2O → Cu3Cl2(OH)4 + CuCl2
കോപ്പർ(I) ക്ലോറൈഡ് ധാരാളം ഓർഗാനിക് പ്രവർത്തനങ്ങളെ കാറ്റലൈസ് ചെയ്യുന്നു. അലൂമിനിയം ക്ലോറൈഡിന്റെ സാന്നിധ്യത്തിൽ കാർബൺ മോണോക്സൈഡിനോടുള്ള കോപ്പർ(I) ക്ലോറൈഡിന്റെ അഭിനിറ്റി കാർബൺമൊണോക്സൈഡിന്റെ പൂരിഫിക്കേഷൻ പ്രക്രിയയ്ക്കു പ്രയോജനപ്പെടുത്തുന്നു.
ബെൻസാൾഡിഹൈഡ് രൂപീകരണത്തിനുവേണ്ടി ഗട്ടർമാർ കോച്ച് പ്രതിപ്രവർത്തനത്തിൽ കോപ്പർ(I) ക്ലോറൈഡിന്റെ കൂടെ കാർബൺ മോണോക്സൈഡ്, അലൂമിനിയം ക്ലോറൈഡ്, ഹൈഡ്രജൻ ക്ലോറൈഡ് എന്നിവ ഉപയോഗിക്കുന്നു.
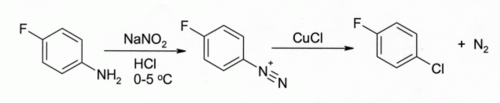
സാൻഡ്മേയർ റിയാക്ഷനിൽ[8][9] കോപ്പർ(I) ക്ലോറൈഡും അറിനിഡയസോണിയം സാൾട്ടും തമ്മിലുള്ള പ്രവർത്തനം വഴി അറൈൽ ക്ലോറൈഡ് ഉണ്ടാകുന്നു.
ആദ്യകാല അന്വേഷകർ നിരീക്ഷിച്ചു
ആറ്റം ട്രാൻസ്ഫർ റാഡിക്കൽ പോളിമറൈസേഷനിൽ കോപ്പർ(I) ക്ലോറൈഡ് കാറ്റലിസ്റ്റായി ഉപയോഗിക്കുന്നു. ഇതുകൂടാതെ ധാരാളം ഓർഗാനിക് സംയുക്തങ്ങളുടെ നിർമ്മാണത്തിനും ഉപയോഗിക്കുന്നു.
അവലംബം
പുറം കണ്ണികൾ
- National Pollutant Inventory – Copper and compounds fact sheet
- The COPureSM Process for purifying CO utilizing a copper chloride complex
- ↑ Pastor, Antonio C. (1986) ഫലകം:US Patent "Method of preparing cupric ion free cuprous chloride" Section 2, lines 4–41.
- ↑ ഫലകം:Cite book
- ↑ ഫലകം:Cite journal
- ↑ ഫലകം:Cite book
- ↑ ഫലകം:Cite book
- ↑ ഫലകം:Cite book
- ↑ Glemser, O. and Sauer, H. (1963) "Copper(I) Chloride" in Handbook of Preparative Inorganic Chemistry, 2nd ed. G. Brauer (ed), Academic Press, NY. Vol. 1. p. 1005.
- ↑ Wade, L. G. (2003) Organic Chemistry, 5th ed., Prentice Hall, Upper Saddle River, New Jersey, p. 871. ഫലകം:ISBN.
- ↑ March, J. (1992) Advanced Organic Chemistry, 4th ed., Wiley, New York. p. 723. ഫലകം:ISBN